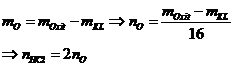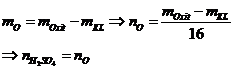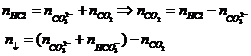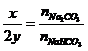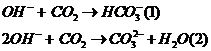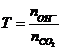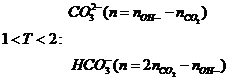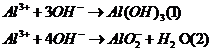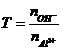Công Thức Hóa Học Dành Cho Ôn Thi TỐt Nghiệp Quốc Gia
Home » gia sư hóa TPHCM » công thức hóa học
Công Thức Hóa Học Dành Cho Ôn Thi TỐt Nghiệp Quốc Gia. Công thức giải bài tập đơn giản, các lưu ý và kiến thức về ứng dụng chắt lọc từ SGK dùng cho HS trung bình ôn ngày cuối.
|
STT |
Chủ đề |
Phản ứng |
Công thức tính |
|
1 |
Este |
Phản ứng xà phòng hóa
RCOOR’ + NaOH
®RCOONa + R’OH |
m
Muối = mRCOONa
m Rắn = mRCOONa + mNaOH dư |
|
(RCOO)3R’ + 3NaOH
®3RCOONa + C3H5(OH)3 |
mCB + mNaOH = mxp + m
glixerol |
||
|
2
|
Chất béo |
Phản ứng cháy
CnH2nO2
+ (3n-2)/2 O2®nCO2 + nH2O |
n este.2 + 2nO2 =
2nCO2 + nH2O
|
|
CxHyO6
+ O2® CO2 + H2O
|
nCB.6 + 2nO2 =
2nCO2 + nH2O
mCB+ mO2 = mCO2 + mH2O
|
||
|
CxHyO6
+ (k-3) H2®
CxHyO6
+ (k-3) Br2® |
|
||
|
3 |
Cacbohidrat |
Pứ lên men:
Pứ tráng bạc:
Pứ cháy của hh gluco, saccarozo, Tinh
bột, xen |
nO2 = nCO2
mhh + mO2 = mCO2 + mH2O |
|
4 |
Amin
|
RNH2 + HCl
® RNH3Cl
Amin no đơn chức CnH2n+3N |
mRNH2 + mHCl = m Muối
nN
= nHCl |
|
Phản ứng cháy:
|
|
||
|
5 |
Amino axit |
H2N-R-COOH +HCl®ClH3N-R-COOH
(H2N)a-R-COOH
+aHCl®(ClH3N)a-R-COOH |
m Aminoaxit + mHCl = m Muối
nHCl = nN |
|
H2N-R-COOH + NaOH®H2N-R-COONa+ H2O
H2N-R-(COOH)b +
bNaOH®H2N-R-(COONa)b+ H2O |
m Aminoaxit + mNaOH = m Muối+mH2O
nNaOH = nCOOH |
||
|
(H2N)a-R-(COOH)b
+ HCl® dung dịch Y
Amino
axit X
ddY
+ c mol NaOH
® dd Z, mZ = ? |
Sn axit =
S n bazo
nAminoaxit . b + nHCl = nNaOH
mA.A X + mHCl +mNaOH=mZ+ mH2O |
||
|
(H2N)a-R-(COOH)b
+ NaOH® dung dịch Y
Amino
axit X
ddY
+ c mol HCl
® dd Z, mZ = ? |
Sn axit =
S n bazo
nAminoaxit . a + nNaOH = nHCl
mA.A X + mHCl +mNaOH=mZ+ mH2O |
||
|
6 |
Peptit |
n-peptit
+ nHCl+ (n-1)H2O
® Muối
|
Dùng định luật bảo toàn khối lượng để
tính |
|
n-peptit
+ n NaOH
® Muối + H2O |
|||
|
7 |
Đại cương kim loại
Tác dụng axit |
Kim loại + HCl®Muối + H2
(trừ Pb, Cu, Ag, Hg, Au, Pt không tác
dụng) |
mMuoi clorua= mKL + 71.nH2 |
|
Kim loại + H2SO4®Muối + H2
(trừ Pb, Cu, Ag, Hg, Au, Pt không tác
dụng) |
mMuoi sunfat= mKL + 96.nH2 |
||
|
Kim loại + H2SO4 đặc
®Muối + SO2 + H2O
(trừ Au, Pt không tác dụng) |
mMuoi sunfat= mKL + 96.nSO2
nH2SO4 = 2nSO2
; nSO4 tạo muối = nSO2 |
||
|
Kim loại + HNO3
®Muối + N2/N2O/NO/NO2 + H2O
(trừ Au, Pt không tác dụng) |
mMuoi nitrat= mKL + 62.α.nkhí
α = (5 – số oxi hóa
của N trong khí)
nHNO3 = 2nNO2 ;
nNO3 tạo muối = nNO2
Nếu có NH4NO3 thì
:
mMuoi nitrat= mKL + 62.α.ne nhận+mNH4NO3 |
||
|
Tác dụng oxi sau đó cho hh tác dụng axit |
Kim loại + O2® hh oxit X
Hh oxit X + HCl® hh muối Y
|
mMuối = moxit X + mHCl – mH2O |
|
|
|
|
Kim loại + O2® hh oxit X
Hh oxit X + H2SO4® hh muối Y
|
mMuối = moxit X + mH2SO4
– mH2O |
|
Tác dụng hh axit |
Hh kim loại + hh ( HCl + H2SO4
loãng )® hh muối Y |
mMuoi = mKL + mCl + mSO4
= mKL + 35,5nHCl + 96nH2SO4 |
|
|
Tác dụng muối
Nếu hh kim loại td muối thì dùng qui tắc
α xét thứ tự pứ |
Fe + CuSO4® FeSO4 +
Cu
56x
x
x
64x
Nếu đề cho nFe và nCuSO4 thì
phải xem:
Sau pứ thu được kim loại Cu hoặc Cu và
Fe dư |
Khối lượng tăng = 64x – 56x = 8x
mol= x =
|
|
|
Cu + 2AgNO3® Cu(NO3)2 +
2Ag
64x
2x
x
216x
|
Khối lượng tăng = 216x – 64x = 152x
mol= x =
|
||
|
8 |
Kim loại tan trong nước |
M + H2O
® MOH + H2
M2Ox + H2O
® M(OH)x |
mdd sau pư = mKL + mH2O -mH2
mdd sau pư = moxit + mH2O
Vdd sau pứ = VH2O |
|
Hh( Na , Al) cho vào H2O thì
nNa.1 + nAl .3 = 2nH2 |
|
||
|
Hh( Ba , Al) cho vào H2O thì
nBa.2 + nAl .3 = 2nH2 |
|
||
|
9 |
Pứ nhiệt nhôm |
Al
+ FexOy
® Al2O3 + Fe
Hh sau pứ tác dụng NaOH có H2
bay ra suy ra Al dư
Hh sau pứ tác dụng axit tạo n1
mol H2;
tác dụng bazo tạo n2 mol H2 |
Thì nAl dư = n2/ 1,5 ,
nFe = n1 – n2
suy ra nFexOy bằng
bảo toàn ngto Fe
Rồi tính theo yêu cầu đề bài |
|
10 |
Bài toán cho từ từ HCl vào dd Na2CO3
và NaHCO3 |
Ban đầu không có khí, HCl dư mới có khí
Na2CO3 + HCl® NaHCO3 + NaCl
NaHCO3 + HCl
® NaCl + CO2 + H2O |
|
|
Bài toán cho hh Na2CO3
và NaHCO3 vào dd HCl |
Có khí bay ra từ đầu:
Na2CO3 + 2HCl® 2NaCl + CO2 + H2O (1)
NaHCO3 + HCl
® NaCl + CO2 + H2O(2) |
Gọi x là nHCl pứ (1); y là nHCl pứ (2)
Thì
x+ y = nHCl và
Từ đó nCO2 = x/2 + y |
|
|
11 |
Bài toán CO2 tác dụng OH- |
Nếu sau pứ cho tác dụng Ba(OH)2,
Ca(OH)2 thu kết tủa
Bài toán cho CO2 vào nước vôi
trong Ca(OH)2
¯max khi nCO2=nCa(OH)2
¯min khi nCO2=2nCa(OH)2 |
|
|
12 |
Bài toán Al3+ tác dụng OH- |
|
|
|
Lý thuyết cần nhớ |
|||
|
13 |
Lưu ý |
Thu khí dời nước dùng cho O2,
CO2, N2, H2
Thu khí úp bình dùng cho H2 ,
NH3, CH4
Thu khí ngửa bình dùng cho khí O2,Cl2,
CO2, SO2… |
Chiết chất lỏng dùng
cho 2 chất lỏng có độ tan khác nhau
Chưng cất chất lỏng
dùng cho 2 chất lỏng có nhiệt độ sôi khác nhau. |
|
14 |
Hóa môi trường |
Mất màu dd Brom: SO2, H2S,
C2H2, C2H4 |
Tác dụng ddAgNO3/NH3:
C2H2 tạo
¯vàng
RCHO tạo Ag¯ tr |
|
Gây hiệu ứng nhà kính CO2, CH4 |
Mưa axit SO2,
NO2 |
||
|
Xử lý chất thải dùng nước vôi dư Ca(OH)2 |
|
||
|
15 |
Ba(HCO3)2 |
Phản ứng với những chất chứa ion:
|
Tạo kết tủa với những
chất chứa ion:
Vừa tạo khí, vừa tạo kết tủa với H2SO4
và muối HSO4- |
|
15 |
Sơ đồ thí nghiệm |
Al4C3 + 12H2O® 4Al(OH)3 + 3CH4
CaC2 + 2H2O® Ca(OH)2 + C2H2 |
CH3COONa + NaOH
|
|
16 |
Điều kiện
|
Cùng tồn tại là các chất không được phản ứng với
nhau
Các ion không được kết hợp tạo
¯,, H2O,HF… |
Đk phản ứng xảy ra là sản phẩm
phải có chất kết tủa or bay hơi or H2O, HF..đli yếu |
|
|
|
|
|
|
17 |
Chú ý |
1-FeCl2 + AgNO3
tạo 2 kết tủa là AgCl và Ag |
|
|
|
|
2-Fe(NO3)2 + HCl
có giải phóng khí NO và Fe3+ |
16-Giảm mùi tanh của cá ta dùng
giấm ăn |
|
3-FeCl3 + H2S sẽ
tạo kết tủa S màu vàng |
17-Giảm đau nhức khi bị
kiến đốt ta dùng vôi tôi |
||
|
4-S không thể oxi hóa Fe lên Fe3+ |
18.Na-K dùng làm
chất trao đổi nhiệt trong lò phản ứng hạt nhân |
||
|
5-Nung hợp chất sắt trong không khí sẽ
tạo Fe2O3 |
19-Cs chế tạo tế bào quang điện |
||
|
6-hhFe2O3,
Cu, Al sẽ tan hoàn toàn trong HCl dư ( nFe2O3³ nCu) |
20-Muối Na2CO3 là
nguyên liệu trong CN sản xuất thủy tinh, xà phòng, giấy, dệt, chất tẩy rửa |
||
|
7-amino axit ( glyxin, alanin,
valin, lysin, a.glutamic) không tác dụng Cu(OH)2 |
21-Dd Na2CO3 dùng tẩy
sạch vết mỡ bám trên chi tiết máy trước khi sơn, tráng kim loại. |
||
|
8-Protein bị đông tụ
khi đun nóng và khi ngâm trong dd NaCl bão hòa |
22-NaHCO3 dùng trong y học, công nghệ thực phẩm, chế tạo nước giải khát… |
||
|
9-CaCO3 trong CN sx xi măng,thủy tinh,gang, thép, xoda, vôi, cao su |
23-Be làm chất phụ gia chế tạo hợp kim có tình đàn hồi cao, bền chắc, không bị ăn mòn |
||
|
10-CaO là nguyên liệu sx vật liệu xây dựng, chất
tẩy trắng, sát trùng( clorua vôi) |
24-Mg dùng chế tạo hợp kim cứng, nhẹ, bền dùng chế tạo máy bay, tên lửa, ô tô…ngoài ra còn dùng tổng hợp nhiều chất hữu cơ. Trộn với chất oxi hóa chế tạo chất chiếu sáng ban đêm |
||
|
11-Ca(OH)2là chất làm khô, sx canxi cacbua CaC2,
Khử chua cho đất trồng trọt,dùng điều chế NaOH trong PTN, thuốc thử nhận biết
cacbondioxit |
|||
|
12-CaSO4.H2O Thạch cao nung dùng đúc tượng, bó bột, trang trí nội thất, phấn viết bảng.
Thạch cao sống dùng sx xi măng |
25-Ca dùng làm chất khử tách O, S ra khỏi thép, làm khô một số chất hữu cơ |
||
|
|
|
13-Al làm vật liệu chế tạo mày bay, ô tô, tên lửa, tàu vũ trụ Trang trí nội thất, thiết bị trao đổi nhiệt, đun nấu
Chế tạo hỗn hợp tecmit( hh bột Al và Fe2O3) để hàn gắn
đường ray |
26-CrO3 chất
rắn màu đỏ thẫm, có tính oxi hóa rất mạnh.
Một số chất như S, P,
C, NH3,C2H5OH..bốc cháy khi tiếp xúc với CrO3 CrO3 là một oxit axit, tác dụng với nước tạo hỗn hợp 2 axit, 2 axit này không tách rời ở dạng tự do |
|
14-Phèn chua: K2SO4.Al2(SO4)3.24H2O Phèn chua dùng trong ngành thuộc da,Công nghiệp giấy( làm giấy không thấm nước). Chất cầm màu trong CN dệt vải và chất làm trong nước đục. |
27-Muối cromat
Muối đicromat
|
||
|
15-Boxit: Al2O3.2H2O
nguyên liệu sx nhôm
Emeri: Al2O3
dạng khan dùng làm đá mài
Corindon ( tinh thể Al2O3)
ngọc thạch rất cứng.
Rubi (ngọc màu đỏ) Al2O3
có lẫn Cr2O3 Saphia ( ngọc màu xanh) Al2O3 có lẫn TiO2 và Fe3O4
|
28-Cho axit vào muối cromat
|
||
|
29- Cho bazo vàođicromat
|
|||
|
|
|||
|
|
|
|
|
|
|
Quặng |
QUẶNG CANXI-MAGIE |
QUẶNG NHÔM |
|
Đá vôi, đá hoa,đá phấn: CaCO3 |
Boxit: Al2O3.nH2O |
||
|
Quặng đôlômit CaCO3.MgCO3
( Đá bạch vân) |
Criolit: Na3AlF6 hay
AlF3.3NaF |
||
|
Florit: CaF2 |
Cao lanh: Al2O3.2SiO2.2H2O |
||
|
Apatit: Ca5F(PO4)3 hay
3Ca3(PO4)2.CaF2 |
Mica: K2O.Al2O3.6SiO2.2H2O |
||
|
Photphorit: Ca3(PO4)2 |
Corindon ( tinh thể Al2O3) |
||
|
Cacnalit: KCl.MgCl2.6H2O |
Rubi, Saphia… |
||
|
QUẶNG SẮT |
QUẶNG DÙNG SX
PHÂN KALI |
||
|
Hematit đỏ: Fe2O3 khan |
Sivinit: KCl.NaCl |
||
|
Hematit nâu (limonit): Fe2O3.nH2O |
Cacnalit: KCl.MgCl2.6H2O |
||
|
Mahetit: Fe3O4 |
|
||
|
Xiderit: FeCO3 |
MỘT SỐ QUẶNG
KHÁC |
||
|
Pirit: FeS2 (không dùng qặng này để điều chế
Fe vì chứa nhiều lưu huỳnh, dùng để điều chế H2SO4) |
Pirit đồng : CuFeS2
|
||
|
|
|
|
|
|
|
Phân bón
|
Phân đạm ( chứa N) |
Phân lân ( chứa P) dùng khử chua |
|
|
|
Độ dinh dưỡng %N |
Độ dinh dưỡng % P2O5 |
|
|
|
Phân Urê:CO(NH2)2 chứa 46.67%N |
Phân lân tự nhiên Ca3(PO4)2 |
|
|
|
Phân amoni nitrat NH4NO3(đạm 2 lá) |
Phân supe phôphat kép Ca(H2PO4)2 |
|
|
|
Phân amoni clorua NH4Cl |
Phân supe phôphat đơn Ca(H2PO4)2 và CaSO4 |
|
|
|
Phân amoni sunfat (NH4)SO4(đạm 1 lá) |
Phân kali ( chứa K) |
|
|
|
Phân đạm khi bón làm chua đất |
Độ dinh dưỡng % K2O Chủ yếu là KCl và K2CO3, K2SO4 |
|
|
|
|
|
|
|
|
PHÂN PHỨC
HỢP: được tổng hợp trực tiếp bằng tương tác hóa học Phân NPK, chứa {NH4NO3, (NH4)2HPO4 và KCl}. Phân amophot, chứa {NH4H2PO4 và (NH4)2HPO4} |
PHÂN HỖN HỢP Phân hỗn hợp: chứa 3 nguyên tố N,P,K =>gọi là phân NPK Phân NPK là hỗn hợp của các muối: (NH4)2HPO4 và KNO3 |
|
|
|
|
|
👉 Xem thêm hồ sơ gia sư
Bài viết cùng chủ đề
Lượt xem: 24